医疗器械GMP净化车间设计装修
医疗器械GMP净化装修设计需了解国家重点监管医疗器械:一次性使用输血、输液、注射用医疗器械;植入材料和人工器官类医疗器械;同种异体医疗器械;动物源医疗器械;计划生育用医疗器械;体外循环及血液处理医疗器械;循环系统介入医疗器械;高风险体外诊断试剂。因此GMP净化车间是生物制药企业在进行药品生产及使用时的最基本条件,对于生物制药行业来说,建设GMP洁净室是一切工作的首要前提和强制规范。
医疗器械GMP净化和装修设计需要了解国家监管的重点医疗器械:一次性输血、输液、注射用医疗器械;植入材料和人工器官医疗器械;同种异体医疗器械;动物源医疗器械;计划生育医疗器械;用于体外循环和血液处理的医疗器械;循环系统介入医疗器械;高风险体外诊断试剂。因此,GMP净化车间是生物制药企业生产和使用药品的最基本条件。对于生物制药行业来说,GMP洁净室的建设是所有工作的首要前提和强制性规范。


一、医疗器械GMP车间的建设原理
对于生物制药及医疗行业来说,建设GMP洁净室是一切工作开展的首要前提和强制规范。净化车间的工作原理主要通过空气过滤来实现。一般要经过初效过滤、中效过滤、高效过滤三个阶段。

气流经初效净化进入加湿段→加热段→表冷段→中效净化→风机送风→管道→高效净化风口→吹入房间→带走尘埃细菌等颗粒→回风百叶窗→初效净化。
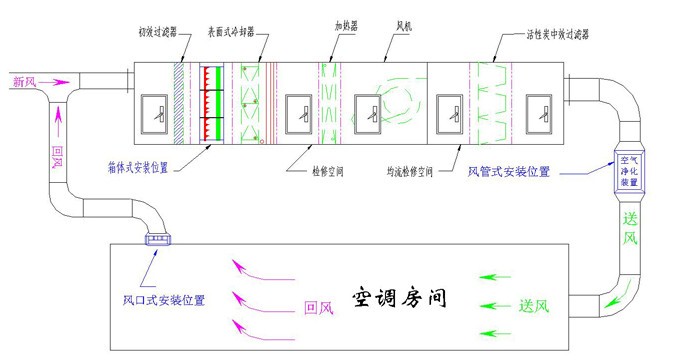

经过这一系列过程,就可以达到净化的目的。但这并不意味着洁净厂房的装修只能靠空调通风来实现。净化车间的装修施工取决于合理的工厂布局、人流和物流净化路线的设置、净化系统的智能自动控制和参数设置、墙面和地面结构的材料和施工工艺等。以建筑结构为例,针对医用药品GMP车间,应根据生产的产品类别确定整体结构。
◇ 医药针剂生产:由于其主要生产设备均用生产联动线,所以对厂房的长宽都有要求,钢筋混凝土结构的厂房不太实用,以砖墙结构为佳。
◇ 固体药剂生产:生产单元步骤相对独立,建议利用厂房原有分隔布置(前提是结合设备情况,事先安排好设备的进场安装及维修路线)。


二、医疗器械车间对应的洁净度标准
1、 植入和介入到血管内的医疗器械,不清洗零部件的加工,末道清洗组装、初包装及其封口,应在不低于万级的洁净车间进行。比如:血管支架、人工血管、静脉导管、血管内导管等等。
2、 植入到人体组织、与血液、骨腔或非自然腔道直接或间接接触的医疗器械,(不清洗)零部件的加工、末道清洗、组装、初包装及其封口等,应在不低于10万级的洁净车间进行。比如:心脏起搏器、血液过滤器、静脉针、人工骨等等。
3、与人体受损表面和粘膜接触的医疗器械零部件的加工、最终清洗、组装、初步包装和密封应在不低于30万级的洁净车间进行。比如:医用脱脂棉、宫内节育器、气管插管等等。
4、与无菌医疗器械使用面直接接触且未经清洗使用的初级包装材料,应遵循与生产环境相同清洁度的原则,使初级包装材料的质量能够满足包装无菌医疗器械的要求。如果初始包装材料不与使用无菌医疗器械的表面直接接触,则应在不低于300,000的洁净车间中进行。比如导尿管、给药装置、注射器、输液器的初始包装材料。


5、对无菌操作技术有要求的,应在万级下的局部100及洁净车间内进行生产。例如血管支架的压制和涂层、血袋生产中的抗凝血剂、维持液的罐装等。
6、生产工艺无特殊要求时,空气洁净度百、万级的洁净室(区)温度应为20℃~24℃,相对湿度应为45%~65%;空气洁净度十万级、三十万级的洁净室(区)温度应为18℃~26℃,相对湿度应为45%~65%。有特殊要求时,应根据工艺要求确定。
7、人员净化用室的温度,冬季应为16℃~20℃,夏季应为26℃~30℃。
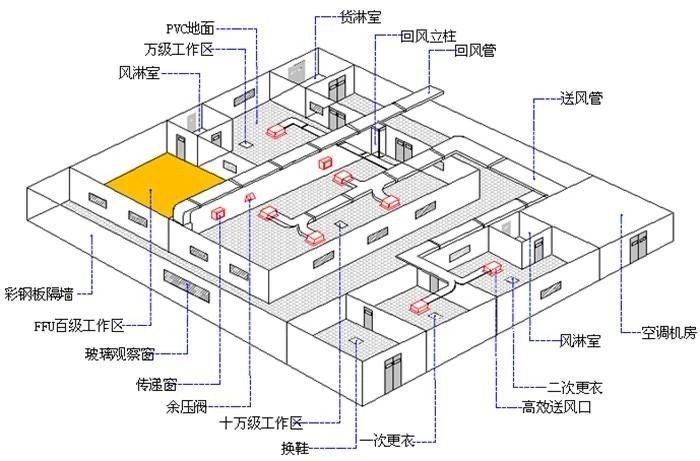
三、医疗器械GMP洁净室的布局要求
1、为避免交叉污染,人员净化室、材料净化室、卫生洁具室、洗衣房、临时储藏室、工位器具清洗室等。必须装备。各个房间相互独立,做到人和物流合理流动。
2、同一个洁净室或相邻洁净室之间没有交叉污染。需要满足三点。第一,生产过程和原材料不会对产品质量产生相互影响;二是为不同级别的洁净室设置气闸室或防污染措施;第三,物料通过双层传送窗口传送。


3、 洁净室内每人的新鲜空气不应小于40m³/h,且要及时补偿室内排风量和保持室内正压所需要的新鲜空气量。
4、 要保证人员的安全操作,洁净室的人均面积不少于4m³(除走廊、设备等物品外)
5、 应标明回风、送风及制水管道的走向。









 沪公网安备 31011002005208号
沪公网安备 31011002005208号